Akut nöromüsküler zayıflık; saatler ya da günler içinde gelişen, motor gücün belirgin şekilde azalması ile karakterize, potansiyel olarak hayatı tehdit eden nörolojik bir acil durumdur. Klinik tablo hafif proksimal güçsüzlükten hızlı progresyon gösteren kuadripleji ve solunum yetmezliğine kadar geniş bir spektrumda seyredebilir. Özellikle solunum kaslarının ve bulber kasların tutulumu, erken dönemde tanınmadığında mortaliteyi belirgin şekilde artırır.
“Nöromüsküler” terimi; ön boynuz hücresi, periferik sinir, nöromüsküler kavşak ve kas düzeyindeki patolojileri kapsar. Bu nedenle akut nöromüsküler zayıflık değerlendirilirken anatomik lokalizasyon temel yaklaşım basamağını oluşturur. Klinik muayenede refleks durumu, duyu eşlik edip etmemesi, simetri, kraniyal sinir tutulumu ve otonom bulgular tanısal yönlendirmede kritik rol oynar.
En sık karşılaşılan nedenler arasında Guillain-Barré sendromu, Miyastenia gravis, Miyastenik kriz ve Botulizm yer alır. Bununla birlikte hipokalemi, hipofosfatemi ve tirotoksik paralizi gibi metabolik nedenler de hızla dışlanmalıdır. Erken dönemde yapılacak basit bir elektrolit değerlendirmesi, invaziv ve maliyetli tetkiklerin önüne geçebilir.
Acil serviste temel yaklaşım; hava yolu güvenliğinin sağlanması, solunum kas gücünün objektif olarak değerlendirilmesi (FVC, NIF), hemodinamik stabilitenin korunması ve hızlı ayırıcı tanı algoritmasının işletilmesidir. Özellikle vital kapasitenin düşmesi veya progresif bulber disfonksiyon varlığı entübasyon için gecikmeden karar verilmesini gerektirir. Unutulmamalıdır ki bu hasta grubunda klinik kötüleşme ani olabilir ve “stabil görünen” hastalar saatler içinde solunum yetmezliğine ilerleyebilir.
Akut nöromüsküler zayıflıkta doğru ve zamanında lokalizasyon; gereksiz görüntülemeleri azaltır, uygun tedavinin (IVIG, plazmaferez, asetilkolinesteraz inhibitörleri, elektrolit replasmanı vb.) hızla başlanmasını sağlar ve prognozu belirgin şekilde iyileştirir. Bu nedenle sistematik ve disiplinli bir yaklaşım esastır.
Guillain-Barré Sendromu
Guillain-Barré sendromu (GBS), periferik sinir sistemini tutan, akut başlangıçlı ve genellikle enfeksiyon sonrası gelişen immün aracılı bir poliradikülonöropatidir. En sık görülen formu akut inflamatuvar demiyelinizan poliradikülonöropati (AIDP) olup, temel patoloji periferik sinir miyelininin otoimmün mekanizmalarla hasarlanmasıdır. Klinik olarak saatler–günler içinde ilerleyen flasid paralizi ile prezente olur ve erken tanı konulmadığında solunum yetmezliği ve otonom instabilite nedeniyle yaşamı tehdit edebilir.
Patofizyoloji
Hastaların çoğunda semptomlardan 1–3 hafta önce geçirilmiş bir enfeksiyon öyküsü bulunur. En sık ilişkilendirilen etken Campylobacter jejuni olmakla birlikte sitomegalovirüs, Epstein-Barr virüs ve influenza gibi ajanlar da tetikleyici olabilir. Moleküler taklit mekanizması sonucunda gelişen otoantikorlar, periferik sinir miyelinine bağlanarak kompleman aktivasyonu ve inflamasyona yol açar. Bu süreç özellikle spinal sinir köklerini ve proksimal sinir segmentlerini etkiler. Sonuçta sinir iletiminde blok ve yavaşlama gelişir.
Klinik Özellikler
GBS tipik olarak günler içinde ilerleyen, simetrik ve asendan karakterde flasid paralizi ile başlar. Güçsüzlük genellikle alt ekstremitelerde başlar, proksimale doğru ilerler ve bazı hastalarda kuadriplejiye kadar ulaşabilir. Refleksler erken dönemde azalır veya tamamen kaybolur; arefleksi hastalığın en karakteristik bulgusudur.
Duyusal semptomlar genellikle hafiftir ve parestezi şeklinde görülür. Belirgin objektif duyu kaybı çoğunlukla motor bulguların gerisinde kalır. Kraniyal sinir tutulumu özellikle fasiyal paralizi şeklinde görülebilir. Bulber kas tutulumu disfaji ve aspirasyon riskine yol açabilir.
GBS’nin en tehlikeli yönlerinden biri otonom sinir sistemi tutulumu riskidir. Taşikardi, bradikardi, aritmi, labil hipertansiyon ve ortostatik hipotansiyon gelişebilir. Bu nedenle hastaların kardiyak monitörizasyon altında izlenmesi önemlidir.
Solunum Yetmezliği Riski
Hastaların yaklaşık %20–30’unda solunum kas tutulumu nedeniyle entübasyon ve mekanik ventilasyon gereksinimi ortaya çıkar. Hızlı progresyon, bulber kas zayıflığı ve vital kapasitede düşüş solunum yetmezliği açısından uyarıcı bulgulardır. Seri solunum fonksiyon takibi (özellikle FVC ve NIF ölçümleri) erken entübasyon kararında kritik öneme sahiptir.
Tanı
Tanı öncelikle klinik bulgulara dayanır. Destekleyici incelemeler şunlardır:
- Lomber ponksiyon: Albüminositolojik dissosiasyon (yüksek protein, normal hücre sayısı). Ancak ilk günlerde normal olabilir.
- Elektromiyografi ve sinir iletim çalışmaları: Demiyelinizasyon bulguları, iletim blokları ve iletim hızında yavaşlama.
Ayırıcı tanıda spinal kord patolojileri, metabolik paraliziler ve nöromüsküler kavşak hastalıkları düşünülmelidir.
Tedavi
Tedavinin temelini immünomodülatör yaklaşımlar oluşturur. İntravenöz immünoglobulin (IVIG) veya plazmaferez hastalığın süresini kısaltır ve iyileşmeyi hızlandırır. İki tedavi yöntemi birlikte uygulanmaz. Kortikosteroidlerin tek başına etkinliği gösterilmemiştir.
Destek tedavisi en az immün tedavi kadar önemlidir. Solunum desteği, otonom instabilitenin yönetimi, tromboemboli profilaksisi ve erken rehabilitasyon prognozu belirgin şekilde etkiler.
Prognoz
Çoğu hastada haftalar–aylar içinde anlamlı iyileşme görülür. Ancak ağır seyreden olgularda kalıcı güçsüzlük veya nörolojik sekeller gelişebilir. Erken tanı, uygun immün tedavi ve dikkatli yoğun bakım izlemi mortaliteyi belirgin şekilde azaltır.
Guillain-Barré sendromu, hızlı progresyon gösterebilen ve özellikle solunum ile otonom komplikasyonlar açısından yakın izlem gerektiren, ancak zamanında müdahale edildiğinde büyük oranda geri dönüşümlü olan önemli bir nörolojik acildir.
Akut Motor Aksonal Nöropati
Akut motor aksonal nöropati (AMAN), Guillain-Barré sendromunun aksonal varyantlarından biridir ve periferik sinirlerin özellikle motor aksonlarını tutan, akut başlangıçlı, immün aracılı bir nöropatidir. Klinik olarak klasik demiyelinizan GBS’ye benzer şekilde akut flasid paralizi ile prezente olur; ancak patofizyolojik mekanizma ve elektrofizyolojik bulgular açısından farklılık gösterir.
Patofizyoloji
AMAN’da temel patoloji miyelin kılıfta değil, doğrudan motor aksonlarda hasar gelişmesidir. Hastalık çoğunlukla enfeksiyon sonrası ortaya çıkar ve en sık ilişkilendirilen etken Campylobacter jejuni’dir. Moleküler taklit mekanizması sonucu gelişen anti-gangliozid antikorları (özellikle GM1 ve GD1a’ya karşı) motor sinir aksonlarına bağlanarak kompleman aktivasyonuna ve aksonal hasara yol açar. Bu nedenle demiyelinizasyon değil, aksonal dejenerasyon ön plandadır.
Klinik Özellikler
Hastalık genellikle günler içinde hızla ilerleyen, simetrik, flasid paralizi ile başlar. Güçsüzlük çoğunlukla alt ekstremitelerde başlar ve proksimale ilerler. Refleksler azalmış ya da kaybolmuştur. AMAN’ın en ayırt edici özelliği duyusal liflerin korunmuş olmasıdır; hastalarda belirgin duyu kaybı genellikle yoktur. Paresteziler minimaldir veya hiç görülmez.
Bazı olgularda progresyon klasik GBS’ye göre daha hızlıdır ve erken dönemde ciddi kas güçsüzlüğü gelişebilir. Solunum kas tutulumu riski mevcuttur ve yoğun bakım gereksinimi ortaya çıkabilir. Otonom disfonksiyon, demiyelinizan forma göre daha az sıktır ancak tamamen yok değildir.
Tanı
Tanı klinik bulgular ve elektrofizyolojik incelemeler ile desteklenir. Sinir iletim çalışmalarında:
- Motor yanıt amplitüdlerinde belirgin azalma
- İletim hızında belirgin yavaşlama olmaması
- İletim bloğu veya belirgin demiyelinizasyon bulgularının olmaması
saptanır. Bu bulgular aksonal hasarı düşündürür. Lomber ponksiyonda albüminositolojik dissosiasyon görülebilir; ancak erken dönemde normal olabilir. Anti-gangliozid antikorları bazı hastalarda pozitif bulunabilir ve tanıyı destekler.
Tedavi
Tedavi yaklaşımı klasik GBS ile aynıdır. İntravenöz immünoglobulin (IVIG) veya plazmaferez uygulanır. Kortikosteroidlerin etkinliği gösterilmemiştir. Solunum fonksiyonları seri olarak izlenmeli, vital kapasite düşüşü ve bulber zayıflık açısından dikkatli olunmalıdır.
Prognoz
Aksonal hasar nedeniyle iyileşme süresi demiyelinizan forma göre daha uzun olabilir. Ancak erken ve uygun tedavi ile birçok hastada anlamlı iyileşme sağlanır. Ağır aksonal dejenerasyon gelişen olgularda kalıcı güçsüzlük riski daha yüksektir.
Miyastenia Gravis
Miyastenia gravis (MG), nöromüsküler kavşakta postsinaptik asetilkolin reseptörlerine karşı gelişen otoimmün antikorlar nedeniyle ortaya çıkan, dalgalanan ve yorgunlukla artan kas güçsüzlüğü ile karakterize kronik bir hastalıktır. Temel patoloji sinir-kas iletiminde bozulmadır; kasın kendisi sağlamdır ancak nöromüsküler iletim etkin değildir. Klinik olarak özellikle oküler ve bulber kas tutulumu ile dikkat çeker ve bazı hastalarda solunum yetmezliğine ilerleyebilen akut alevlenmeler görülebilir.
Patofizyoloji
Hastaların çoğunda asetilkolin reseptörlerine (AChR) karşı antikorlar saptanır. Daha az sıklıkla MuSK (muscle-specific kinase) antikorları pozitif olabilir. Bu otoantikorlar postsinaptik membranda reseptör sayısını azaltır, yapısal hasara yol açar ve sinaptik iletimi zayıflatır. Sonuç olarak tekrarlayan kas aktivitesiyle birlikte kas gücü azalır. Bu durum klinikte tipik “fatigabilite” bulgusu olarak karşımıza çıkar.
Timus bezi patogenezde önemli rol oynar. Hastaların bir kısmında timik hiperplazi, bir kısmında ise timoma bulunabilir.
Klinik Özellikler
MG’nin en belirgin özelliği dalgalanan kas güçsüzlüğüdür. Güçsüzlük gün içinde artar, istirahatle düzelir. En sık tutulan kas grupları:
- Oküler kaslar: Ptosis ve diplopi
- Bulber kaslar: Disfaji, dizartri, nazal konuşma
- Yüz kasları: “Miyastenik yüz” görünümü
- Proksimal ekstremite kasları
Refleksler genellikle normaldir ve duyu kaybı görülmez. Bu özellik MG’yi periferik nöropatilerden ayırmada önemlidir. Hastalık yalnızca oküler kaslarla sınırlı kalabilir (oküler MG) ya da jeneralize forma ilerleyebilir.
Akut Kötüleşme: Miyastenik Kriz
Miyastenik kriz, MG hastasında akut solunum kas güçsüzlüğü gelişmesiyle ortaya çıkan yaşamı tehdit eden tablodur. Genellikle enfeksiyon, cerrahi, ilaçlar veya stres tetikleyici faktörlerdir. Klinik bulgular: Artan dispne, zayıf öksürük, sekresyon temizleyememe ve belirgin bulber zayıflıktır. Solunum fonksiyonlarının seri değerlendirilmesi önemlidir. Vital kapasitede belirgin düşüş veya negatif inspiratuvar basıncın azalması entübasyon gereksinimini gösterir.
Tanı
Tanı büyük ölçüde kliniktir. Destekleyici testler:
- Serum AChR veya MuSK antikorları
- Elektromiyografide tekrarlayan sinir stimülasyonunda dekremental yanıt
- Tek lif EMG’de artmış jitter
Görüntüleme ile timoma araştırılmalıdır. Ayırıcı tanıda Lambert-Eaton miyastenik sendromu ve Guillain-Barré sendromu düşünülmelidir.
Tedavi
Semptomatik tedavide asetilkolinesteraz inhibitörleri (örneğin piridostigmin) kullanılır. İmmünmodülatör tedaviler (kortikosteroidler, diğer immünsüpresanlar) hastalığın kontrolünde etkilidir. Timoma varlığında cerrahi önerilir. Miyastenik krizde IVIG veya plazmaferez uygulanır ve çoğu hasta yoğun bakım koşullarında izlenir.
Prognoz
Uygun tedavi ile hastaların büyük çoğunluğunda semptom kontrolü sağlanabilir. Ancak akut kriz dönemleri ciddi morbidite ve mortalite riski taşır. Erken tanı ve solunum kaslarının dikkatli izlenmesi prognozu belirgin şekilde iyileştirir.
Miyastenik Kriz
Miyastenik kriz, Miyastenia gravis hastalarında gelişen, solunum kaslarının ve/veya bulber kasların ciddi güçsüzlüğü sonucu ortaya çıkan akut solunum yetmezliği tablosudur. Yaşamı tehdit eden bir nöromüsküler acildir ve çoğu zaman yoğun bakım koşullarında izlem gerektirir. Hastalık sürecinin herhangi bir döneminde ortaya çıkabilir ve bazen miyastenia gravisin ilk bulgusu olarak da görülebilir.
Patofizyoloji
Miyastenik krizde temel problem, nöromüsküler kavşakta asetilkolin reseptör sayısının azalmasına bağlı olarak sinaptik iletimin belirgin derecede bozulmasıdır. Artmış antikor aktivitesi veya tetikleyici faktörler sonucunda solunum kasları (özellikle diyafram ve interkostal kaslar) ile bulber kaslarda ciddi güçsüzlük gelişir. Sonuçta ventilasyon yetersizliği, sekresyon retansiyonu ve aspirasyon riski ortaya çıkar.
Tetikleyici Faktörler
Miyastenik kriz genellikle bir tetikleyici sonrasında gelişir. En sık nedenler: Solunum yolu enfeksiyonları, cerrahi girişimler, stres ve sistemik hastalıklar, uygunsuz ilaç kullanımı (örneğin aminoglikozidler, beta blokerler, magnezyum), yetersiz veya düzensiz tedavidir.
Klinik Özellikler
Klinik tablo genellikle ilerleyici dispne ve bulber zayıflık ile başlar. Hastalarda artan nefes darlığı, yüzeyel ve hızlı solunum, zayıf öksürük, sekresyon temizleyememe, disfaji, aspirasyon ve nazal konuşma görülür. Fizik muayenede yardımcı solunum kaslarının kullanımı ve paradoksal solunum izlenebilir. Refleksler genellikle korunmuştur ve duyu kaybı yoktur.
Solunum Değerlendirmesi
Solunum fonksiyonlarının objektif takibi hayati önem taşır. Özellikle Zorlanmış Vital Kapasite (FVC) ve Negatif İnspiratuvar Basınç (NIF) seri olarak ölçülmelidir. FVC’nin belirgin düşmesi veya klinik solunum yorgunluğu erken entübasyon kararını gerektirebilir. Entübasyon geciktirilmemelidir.
Ayırıcı Tanı
Miyastenik kriz, antikolinerjik ilaç fazlalığına bağlı gelişen kolinerjik krizden ayrılmalıdır. Kolinerjik krizde muskarinik bulgular (salivasyon artışı, diyare, bradikardi, miyozis) ön plandadır. Ayrıca Guillain-Barré sendromu ve Botulizm gibi diğer nöromüsküler zayıflık nedenleri de ayırıcı tanıda düşünülmelidir.
Tedavi
Miyastenik kriz yönetimi üç temel basamaktan oluşur: Hava yolu ve ventilasyon desteği, İmmünmodülatör tedavi (IVIG veya plazmaferez), Tetikleyici faktörlerin tedavisi. Asetilkolinesteraz inhibitörleri genellikle ventilasyon sağlandıktan sonra dikkatli şekilde düzenlenir.
Prognoz
Uygun ve erken müdahale ile mortalite oranı belirgin şekilde azalmıştır. Ancak geç entübasyon, aspirasyon ve otonom instabilite komplikasyon riskini artırır. Kriz sonrası hastalarda yeniden alevlenme riski bulunabilir.
Lambert-Eaton Miyastenik Sendromu
Lambert-Eaton miyastenik sendromu (LEMS), nöromüsküler kavşakta presinaptik voltaj bağımlı kalsiyum kanallarına karşı gelişen otoantikorlar sonucu ortaya çıkan, kas güçsüzlüğü ve otonom disfonksiyon ile karakterize nadir bir otoimmün hastalıktır. En önemli özelliği, çoğu vakada paraneoplastik olmasıdır; özellikle Küçük hücreli akciğer kanseri ile güçlü ilişki gösterir.
Patofizyoloji
LEMS’te otoantikorlar presinaptik sinir ucundaki P/Q tipi voltaj bağımlı kalsiyum kanallarına bağlanır. Bu durum aksiyon potansiyeli sırasında kalsiyum girişini azaltır ve asetilkolin salınımını düşürür. Mekanizma presinaptiktir; bu yönüyle Miyastenia gravis’ten ayrılır. Tekrarlayan kas aktivitesiyle sinaptik uçta kalsiyum birikimi arttığı için asetilkolin salınımı geçici olarak artar (egzersizle düzelme fenomeni).
Klinik Özellikler
LEMS genellikle yavaş başlangıçlı ve proksimal kas zayıflığı ile prezente olur. En sık alt ekstremite proksimal kasları etkilenir. Tipik bulgular: Simetrik proksimal güçsüzlük, egzersiz sonrası geçici güç artışı, azalmış veya kaybolmuş refleksler, otonom semptomlar (ağız kuruluğu, kabızlık vb.). Oküler tutulum MG’ye göre daha az belirgindir.
Paraneoplastik İlişki
LEMS hastalarının önemli bir kısmında altta yatan küçük hücreli akciğer kanseri bulunur. Bu nedenle özellikle sigara öyküsü olan erişkin hastalarda malignite araştırması yapılmalıdır.
Tanı
Tanı klinik ve elektrofizyolojik bulgularla desteklenir. Elektromiyografide: Düşük başlangıçlı motor yanıt amplitüdü ve yüksek frekanslı stimülasyon sonrası yanıt amplitüdünde belirgin artış (inkremental yanıt) saptanır. Serumda voltaj bağımlı kalsiyum kanalı antikorları pozitif bulunabilir.
Ayırıcı Tanı
- Miyastenia gravis (refleksler genelde normal, egzersizle kötüleşme)
- Guillain-Barré sendromu (arefleksi ve progresif paralizi)
- Proksimal miyopatiler (CK yüksekliği)
Tedavi
Tedavinin temelini altta yatan malignitenin tedavisi oluşturur. Semptomatik tedavide asetilkolin salınımını artıran ilaçlar (örneğin 3,4-diaminopiridin) kullanılabilir. İmmünmodülatör tedaviler seçilmiş hastalarda uygulanabilir.
Prognoz
Paraneoplastik olmayan vakalarda prognoz genellikle daha iyidir. Paraneoplastik olgularda prognoz büyük ölçüde altta yatan malignitenin seyrine bağlıdır.
Botulizm
Botulizm, nöromüsküler kavşakta asetilkolin salınımının presinaptik düzeyde bloke edilmesi sonucu gelişen, akut ve potansiyel olarak ölümcül bir paralizi tablosudur. En sık etken Clostridium botulinum tarafından üretilen botulinum toksinidir. Klinik olarak tipik olarak desendan flasid paralizi ile karakterizedir.
Patofizyoloji
Botulinum toksini, presinaptik sinir terminalinde SNARE proteinlerini inhibe ederek asetilkolin veziküllerinin sinaptik aralığa salınımını engeller. Sonuçta nöromüsküler iletim tamamen bloke olur. Bu mekanizma presinaptiktir ve geri dönüşümü yeni sinaptik uçların oluşmasını gerektirir.
Klinik Özellikler
Botulizmin en karakteristik özelliği simetrik, desendan flasid paralizi gelişmesidir. Klinik genellikle kraniyal sinir tutulumu ile başlar: Diplopi, ptosis, bulanık görme, pupilla dilatasyonu, disfaji, dizartri. İlerleyen dönemde boyun, üst ekstremite ve solunum kasları etkilenir. Bilinç açıktır.
Klinik Formlar
- Gıda kaynaklı botulizm (en sık erişkinde)
- Yara botulizmi
- İnfant botulizmi
- İyatrojenik botulizm
Tanı
Tanı esas olarak kliniktir. Ani başlayan desendan paralizi, pupilla tutulumu ve bilinç açıklığı önemli ipuçlarıdır. Laboratuvar doğrulama için serum veya dışkıda toksin saptanabilir; ancak tedavi klinik şüphe üzerine başlanmalıdır.
Solunum Yetmezliği Riski
Botulizmde solunum kas tutulumu ani gelişebilir. Seri solunum değerlendirmesi yapılmalı ve erken entübasyon kararı geciktirilmemelidir.
Tedavi
Tedavinin temelini antitoksin uygulaması oluşturur. Antitoksin, dolaşımdaki serbest toksini nötralize eder. Destek tedavi (mekanik ventilasyon, beslenme vb.) esastır.
Prognoz
Uygun destek tedavisi ile mortalite belirgin şekilde azalmıştır. Ancak iyileşme haftalar–aylar sürebilir.
Akut Miyozit
Akut miyozit, kas dokusunun inflamasyonu sonucu gelişen ve saatler–günler içinde ortaya çıkan kas ağrısı ve güçsüzlük ile karakterize bir klinik tablodur. Klinik spektrum hafif, kendini sınırlayan kas hassasiyetinden ciddi kas yıkımına ve rabdomiyolize kadar uzanabilir.
Patofizyoloji
Akut miyozitte temel mekanizma kas liflerinde inflamasyon ve hücresel hasardır. Enfeksiyöz miyozit en sık influenza virüsleri ile ilişkilidir. Ayrıca bakteriyel enfeksiyonlar ve bazı ilaçlar (statinler) neden olabilir.
Klinik Özellikler
En belirgin bulgular: Proksimal kas güçsüzlüğü, kas hassasiyeti ve ağrı, yürümede zorlanma, merdiven çıkmada güçlüktür. Çocuklarda özellikle baldır kaslarında ağrı görülür. Refleksler genellikle korunmuştur ve duyu kaybı yoktur.
Laboratuvar Bulguları
En önemli parametre kreatin kinaz (CK) düzeyidir. CK genellikle yükselmiştir. Ayrıca AST/ALT yüksekliği, LDH artışı ve ağır olgularda idrarda miyoglobin görülebilir.
Ayırıcı Tanı
- Rabdomiyoliz (çok yüksek CK, böbrek riski)
- Guillain-Barré sendromu (arefleksi, asendan paralizi)
- Miyastenia gravis (dalgalanan güçsüzlük, CK normal)
Tedavi
Tedavi altta yatan nedene yöneliktir. Viral miyozitlerde istirahat, sıvı desteği ve ağrı kontrolü yeterlidir. Otoimmün miyozitlerde immünsüpresif tedavi gerekebilir.
Prognoz
Viral akut miyozit genellikle iyi seyirlidir ve kalıcı hasar bırakmaz. Ancak ağır rabdomiyolize ilerleyen durumlarda komplikasyon riski artar.
Rabdomiyoliz
Rabdomiyoliz, iskelet kası hücrelerinin akut yıkımı sonucu hücre içi içeriklerin dolaşıma salınması ile karakterize bir klinik tablodur. En önemli komplikasyonu akut böbrek hasarıdır.
Patofizyoloji
Miyoglobin böbrek tübüllerinde birikerek toksik etki ve tübüler obstrüksiyon oluşturur. Hücresel yıkım sonucu gelişen hiperkalemi kardiyak aritmi riskini artırır.
Nedenler
Travma, uzun süre immobilizasyon, aşırı egzersiz, ısı çarpması, nöbet, ilaçlar ve metabolik bozukluklar neden olabilir.
Klinik Özellikler
Klasik triad: Kas ağrısı, kas güçsüzlüğü ve koyu renkli idrardır. Fizik muayenede kas hassasiyeti ve şişlik görülebilir. Kompartman sendromu eşlik edebilir.
Laboratuvar Bulguları
Kreatin kinaz (CK) genellikle normalin 5 katından fazla artmıştır. Diğer bulgular: Miyoglobinüri, hiperkalemi, hiperfosfatemi, hipokalsemi ve kreatinin yükselmesidir.
Tedavi
Tedavinin temelini erken ve agresif intravenöz sıvı replasmanı oluşturur. Amaç yeterli idrar çıkışı sağlamaktır. Hiperkaleminin acil tedavisi ve gerekirse diyaliz uygulanır.
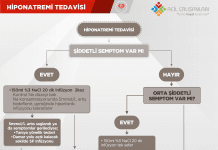
Hipokalemik Paralizi
Hipokalemik paralizi, serum potasyum düzeyinin belirgin şekilde düşmesine bağlı olarak gelişen flasid paralizi tablosudur. Doğru potasyum replasmanı ile çoğu hasta tamamen düzelir.
Patofizyoloji
Serum potasyumunun düşmesi kas hücresinde hiperpolarizasyona yol açar ve flasid paralizi ortaya çıkar. Nedenler arasında gastrointestinal kayıplar, diüretik kullanımı ve potasyumun hücre içine kayması (insülin artışı vb.) yer alır.
Klinik Özellikler
Simetrik flasid paralizi, proksimal kas tutulumu, reflekslerde azalma ve bilinç açıklığı karakteristiktir. Ataklar sıklıkla gece veya sabaha karşı, ağır karbonhidratlı yemek sonrası gelişir.
Tedavi
Kontrollü potasyum replasmanı yapılır. Replasman sırasında EKG monitörizasyonu önerilir. Altta yatan neden mutlaka araştırılmalıdır.
Tirotoksik Paralizi
Tirotoksik paralizi, hipertiroidi zemininde gelişen ve hipokalemiye bağlı ortaya çıkan flasid paralizi tablosudur. En sık genç erkeklerde görülür.
Patofizyoloji
Tiroid hormonları Na+/K+-ATPaz pompasının aktivitesini artırarak potasyumun hücre içine kaymasına yol açar. Gerçek potasyum kaybı yoktur.
Tedavi
Hipokaleminin kontrollü düzeltilmesi ve tirotoksikozun kontrolü (beta blokerler, antitiroid ilaçlar) hedeflenir. Rebound hiperkalemi riskine dikkat edilmelidir.
Sonuç
Sonuç olarak akut nöromüsküler zayıflıkta başarı; hızlı klinik lokalizasyon, hayatı tehdit eden komplikasyonların erken fark edilmesi ve altta yatan nedene yönelik zamanında tedavi ile mümkündür. Sistematik, disiplinli ve dikkatli bir yaklaşım mortalite ve morbiditeyi belirgin şekilde azaltır.
KAYNAKLAR
- Willison HJ, Jacobs BC, van Doorn PA. Guillain-Barré syndrome. Lancet. 2016;388:717-727.
- Van den Berg B, Walgaard C, Drenthen J, et al. Guillain-Barré syndrome: pathogenesis, diagnosis, treatment and prognosis. Nat Rev Neurol. 2014;10:469-482.
- Dimachkie MM, Barohn RJ. Guillain-Barré syndrome and variants. Neurol Clin. 2013;31:491-510.
- Gilhus NE. Myasthenia gravis. N Engl J Med. 2016;375:2570-2581.
- Sanders DB, Wolfe GI, Benatar M, et al. International consensus guidance for management of myasthenia gravis. Neurology. 2016;87:419-425.
- Narayanaswami P, Sanders DB, Wolfe G, et al. International consensus guidance for management of myasthenia gravis: 2020 update. Neurology. 2021;96:114-122.
- Titulaer MJ, Lang B, Verschuuren JJ. Lambert-Eaton myasthenic syndrome: from clinical characteristics to therapeutic strategies. Lancet Neurol. 2011;10:1098-1107.
- Oh SJ. Lambert-Eaton myasthenic syndrome: clinical and electrophysiologic features. Muscle Nerve. 2019;60:663-672.
- Sobel J. Botulism. Clin Infect Dis. 2005;41:1167-1173.
- Rao AK, Sobel J, Chatham-Stephens K, et al. Clinical guidelines for diagnosis and treatment of botulism. MMWR Recomm Rep. 2021;70:1-30.
- Chavez LO, Leon M, Einav S, Varon J. Beyond muscle destruction: a systematic review of rhabdomyolysis. Crit Care. 2016;20:135.
- Huerta-Alardín AL, Varon J, Marik PE. Bench-to-bedside review: Rhabdomyolysis – an overview. Crit Care. 2005;9:158-169.
- Statland JM, Fontaine B, Hanna MG, et al. Review of the diagnosis and treatment of periodic paralysis. Muscle Nerve. 2018;57:522-530.
- Kung AW. Clinical review: Thyrotoxic periodic paralysis. J Clin Endocrinol Metab. 2006;91:2490-2495.