COVID-19 mRNA AŞISI (BNT162b2 ) hücresiz ortamda in vitro olarak SARS-CoV-2’nin spike (S) proteinini kodlayan ilgili RNA dizisinin çoğaltılmasıyla elde edilen yüksek derecede saflaştırılmış tek zincirli (5’ucundan başlayan) messenger RNA (mRNA) içerir. BNT162b2 detaylı bilgi için tıklayınız.
COVID-19 mRNA Aşısı (BNT162b2) Uygulama Kural Rehberin tamamına erişmek için tıklayınız
COVID-19 mRNA AŞISI (BNT162b2 ) UYGULAMA KURALLARI
- Aşı, hücresiz ortamda in vitro olarak SARS-CoV-2’nin spike (S) proteinini kodlayan ilgili RNA dizisinin çoğaltılmasıyla elde edilen yüksek derecede saflaştırılmış tek zincirli (5’ucundan başlayan) messenger RNA (mRNA) içerir.
- 1 flakonu (0,45 ml) 6 doz (her bir doz 30 mikrogram lipid nanopartiküller içerisinde BNT162b2 mRNA bulunacak şekilde) içerir.
- Enjektörsüz olarak sunulmaktadır.
- Aşı flakonları sert sarsıntılardan ve darbelerden korunmalıdır.
- Aşı kullanılmadan önce sulandırılarak seyreltilmelidir.
- Flakon sulandırılmadan önce erimiş olması beklenmelidir.
- Sulandırılmamış flakonun görünümü beyaz-kirli beyaz arası renkte donmuş çözelti şeklinde olup beyaz-kirli beyaz renkte opak amorf partiküller içerebilir. Sıvıda herhangi bir renk değişikliği veya başka partiküller görüldüğünde ya da sıvı renksiz hale gelirse flakon kullanılmadan uygun şekilde imha edilmelidir.
- Erimiş flakon sulandırılmadan önce nazikçe ve yavaşça 10 kez ters yüz edilmelidir. Kesinlikle çalkalanmamalıdır. Oda sıcaklığında iken sulandırılmalıdır.
- Erimiş aşı flakonunun tıpası tek kullanımlık antiseptik ile silinir. Aşı, kendi flakonunda tek kullanımlık enjeksiyonluk, steril apirojen binde 9’luk (%0,9) NaCl (serum fizyolojik) çözeltisinden enjektör ile 1,8 ml çekilerek asepsi kurallarına uygun olarak sulandırılır. Bundan başka bir sulandırıcı kullanılamaz. Sulandırılma işlemini takiben ampulde kalan serum fizyolojik çözeltisi uygun şekilde imha edilmeli, başka bir aşının sulandırılması için kullanılmamalıdır. Flakonun 1,8 ml serum fizyolojik çözeltisi ile sulandırılmasını takiben boş sulandırma enjektörü flakon içerisinden çıkartılmadan önce flakon dik durumdayken enjektör ile 1,8 ml hava çekilerek flakon basıncı eşitlenmelidir.
- Flakon sulandırıldıktan sonra nazikçe ve yavaşça 10 kez ters yüz edilmelidir. Kesinlikle çalkalanmamalıdır.
- Sulandırılmış flakonun görünümü kirli beyaz bir çözelti şeklindedir. Flakonda herhangi bir partikül görülmemelidir, herhangi bir partikül ya da renk değişikliği görüldüğünde sulandırılmış flakon kullanılmadan uygun şekilde imha edilmelidir.
- Flakon sulandırılmadan önce veya sulandırıldıktan sonra görünümünde beklenmeyen bir durum gözlemlendiğinde, bu durum mümkünse fotoğraf ile belgelenmeli ve tutanak tutularak Halk Sağlığı Genel Müdürlüğü Aşı ile Önlenebilir Hastalıklar Daire Başkanlığına iletilmek üzere aşının tedarik edildiği birime en hızlı şekilde bilgi verilmelidir.
- Aşı sulandırıldıktan sonra, Sağlık Bakanlığı tarafından bu aşıya özel olarak dağıtılan 1 ml’lik enjektöre çekilerek uygulanmalıdır. Başka bir enjektör kullanılmamalıdır.
- 1 doz 0,3 ml’dir.
- Asepsi kurallarına uygun olarak flakonun tıpası antiseptikle silinmeli, sulandırılmış flakon içerisinden 1 doz (0,3 ml) aşı çekilerek bekletmeden uygulanmalıdır.
- Sulandırılarak kullanıma hazırlanmış olan flakonun içerisinde 6 uygulamalık aşı dozu bulunmaktadır. Her bir doz 0,3 ml olacak şekilde aşı çözeltisi çekilerek uygulanır. 6 doz aşı çekilmesi sonrasında flakonda kalan miktar yeni bir aşı dozu olarak kullanılmadan uygun şekilde imha edilmelidir.
- Aşı, 0,3 ml olarak 90º açı ile kas içine (intramüsküler) uygulanır.
- Deltoid kas içerisine aşı uygulamalarında piston geri çekilmeden aşı uygulanır.
- Aşı sonrası istenmeyen etki takibi yapılabilmesi için aşının tercihen sol üst koldan deltoid kas içerisine uygulanması önerilir.
- Diğer aşılar ile arasında (öncesinde ve sonrasında) iki hafta süre bırakılması tercih edilmelidir. Herhangi bir şekilde, mRNA aşısı bu aralıktan önce uygulanmış ise her iki aşının da tekrarlanmasına gerek yoktur.
-Kuduz, tetanos toksoidi içeren aşılarla, kızamık, hepatit-A/B aşıları gibi temas sonrası uygulanması gereken aşılarla zaman aralığı bırakılmaksızın uygulanabilir.
-Tüberkülin deri testi ise ya aşıyla aynı gün yapılmalı ya da aşı uygulamasından en az dört hafta sonrasına ertelenmelidir.
- Aşı kişiye oturur durumdayken uygulanmalıdır.
- Aşı uygulamasından sonra olası alerjik reaksiyonlar açısından kişi bilgilendirilmeli ve 15 dakika süresince sağlık tesisinden ayrılmamalıdır.
-Alerji öyküsü olan kişiler 30 dakika süresince sağlık tesisinden ayrılmamalıdır.
-Daha sonraki dönemde de herhangi bir yan etki gelişiminde en yakın sağlık kuruluşuna başvurması söylenmelidir.
- Aşı uygulaması öncesinde mutlaka karekod okutulmalıdır. Aşı uygulanan kişiye ait bilgiler “AŞILA” mobil uygulamasına kaydedilecektir.
- Pandemik COVID-19 aşılarının uygulanması sonrasında ortaya çıkabilecek erken ve geç istenmeyen etkiler Halk Sağlığı Yönetim Sistemi (HSYS), Aile Hekimliği Bilgi Sistemi (AHBS) veya Hastane Bilgi Yönetim Sistemi (HBYS) üzerinden bildirilecektir.
- Aşı uygulaması basamakları için “COVID-19 mRNA Aşısı (BNT162b2) Hazırlanması” ve “COVID-19 mRNA Aşısı (BNT162b2) Uygulama Kontrol Listesi” bölümlerine bakınız.
AŞI TAKVİMİ
- En az dört hafta ara ile birer doz olmak üzere toplam iki doz olarak uygulanacaktır.
- İkinci bir talimata kadar aktif COVID-19 hastasına, 180 gün içerisinde COVID-19’u geçirmiş (PCR testiyle doğrulanmış) ve aşının uygulanmasından önceki 10 gün içerisinde doğrulanmış bir COVID-19 vakasıyla temas etmiş kişilere uygulanmayacaktır.
- Aşının her iki dozu da aynı pandemik aşı ile uygulanmalıdır.
- Gebelikte mRNA aşısının (BNT162b2) uygulanmasına ilişkin veri bulunmamaktadır.
-COVID-19’u ağır geçirime riski yüksek olan gebelere kendi istekleri halinde uygulanabilir.
– İlk trimesterde uygulanmaması tercih edilir.
- Emzirme döneminde mRNA aşısının (BNT162b2) uygulanmasına ilişkin veri bulunmamaktadır.
-COVID-19’u ağır geçirme riski yüksek olan emziren kadınlara kendi istekleri halinde uygulanabilir.
- Kontrolsüz epilepsi ve Guillain-Barre Sendromu, transvers myelit gibi enfeksiyonla ve aşıyla alevlenebilen nörolojik hastalık tanısı bulunanlara takip eden klinisyen
tarafından yapılacak değerlendirmeye bağlı olarak aşılama kararı verilir. - İmmün suprese kişilere aşı yanıtının en iyi olabileceği zaman aralığını saptayabilmek
için takip eden klinisyenin değerlendirmesine bağlı olarak aşı uygulanmalıdır. - Trombositopeni ve kanama bozukluğu olan hastalarda intramüsküler enjeksiyon
kanamaya neden olabilir.

• Aşının içeriğinde bulunan herhangi bir maddeye karşı anafilaksi öyküsü varlığında
aşı uygulanmaz.
• Aşının ilk dozunun sonrasında anafilaksi öyküsü varlığında ikinci doz uygulanmaz.
Önlem Alınarak Aşı Uygulanması Gereken Durumlar
• Aşının içeriğinde bulunan herhangi bir maddeye karşı ya da aşının ilk dozunu takiben anafilaksi dışı akut alerjik reaksiyon öyküsü varlığında aşının bir sonraki dozu uygulanmadan önce bir alerji/immünoloji uzmanına danışılmalıdır.
Aşının Ertelenmesi Gereken Durumlar (Geçici Kontrendikasyonlar)
• Aşı, 38ºC ve üzerinde ateşi olan kişilerde, henüz kesin tanı konulamamış akut hastalıklarda, kronik hastalıkların akut atakları sırasında ertelenmelidir.
Sulandırılan Flakonun Kullanım Süresi
• Flakon sulandırıldıktan sonra en geç 6 saat içerisinde kullanılacak şekilde planlanma yapılmalıdır. 6 saatin sonunda flakonda aşı kaldı ise kullanılmamalı ve uygun şekilde imha edilmelidir.
• Sulandırılan flakonun üzerine sulandırılma saati kaydedilerek +2 ile +8°C arasında muhafaza edilmelidir.
• Sulandırılan flakon başka bir yere taşınmamalı, mümkün olduğu kadar sert sarsıntılardan ve çalkalanmalardan korunmalı, aşının uygulandığı sağlık kurumunda bulunan aşı dolabında/buzdolabında muhafaza edilmelidir. Çalkalanmış olan aşı kullanılmamalıdır.
SOĞUK ZİNCİR
- Aşı flakonları, (-)80-(-)60°C’de son kullanma tarihine kadar ışıktan korunmak koşuluyla uygun depolarda muhafaza edilebilmektedir.
- Aşı flakonları, (-)25-(-)15°C’de iki hafta süresince ışıktan korunmak koşuluyla uygun depolarda muhafaza edilebilmektedir.
- Aşı flakonları kuru buz içerisinde, uygun saklama kaplarında, 15 gün süresince muhafaza edilebilmektedir. 15 günün sonunda flakonlar sulandırılmamak kaydıyla en fazla 5 gün (120 saat) süresince +2 ile +8°C arasında saklanabilir. Bu süre içerisinde bölgesel olarak nakil sağlanacak ise en fazla 12 saat içerisinde nakledilmelidir. Yeni kullanım süresi, nakil süresi 120 saatten düşülerek yeniden belirlenmelidir.
- Orijinal ambalajında saklamak ve 10 günde bir koli başına 23 kg kuru buz (9- 16 mm pellet) koymak şartıyla koli bandı ile kapalı şekilde ilave süre kazanmak mümkündür. Ancak bu işlemin en fazla iki kez yapılması önerilmektedir.
- Kuru buzdan çıkartılan donmuş flakonlar +2 ile +8°C arasında erimeye bırakılmalıdır. Bu şekilde 25 ya da 195 flakonluk bir paketin erimesi 2-3 saat alabilmektedir.
- Kuru buzdan çıkartılan donmuş bir flakon 25°C’ye kadar oda sıcaklığında 30 dakika süresince hızla erimesi için bırakılabilir. Ancak bu durumda sulandırılmamak kaydıyla 25°C’ye kadar oda sıcaklığında en fazla iki saat muhafaza edilebilir. Bu şartlarda flakon en geç iki saatin sonunda sulandırılmış olmalıdır. İki saat içerisinde sulandırılmamış erimiş flakonlar buzdolabına geri konulmalıdır.
- Flakonlar kuru buz içerisinde muhafaza edilirken mutlaka kendi paketi içerisinde muhafaza edilmelidir. Doğrudan güneş ışığı, ultraviyole ışığı almasından kaçınılmalı, oda ışığında kalması da mümkün olduğunca en aza indirilmelidir. Erimiş flakonlar ise oda ışığı şartlarında tutulabilir. Sulandırılan flakonun doğrudan güneş ışığı, ultraviyole ışığı almasından kaçınılmalıdır.
- Flakonlar eridikten sonra yeniden dondurulmamalıdır. Aşı, +2 ile +8°C arasında saklanması süresince aşı dolabının herhangi bir rafında muhafaza edilebilir.
-Aşı dolabı özelliği bulunmayan no-frost dolaplarda ise dolap iç cidarına temas etmeyecek ve üfleme kanallarının önünde olmayacak şekilde tercihen dolabın en düşük sıcaklığa sahip alt raflarında saklanması gereklidir.
Uyarı: Kuru buz erirken ortama havadan ağır olan ve zemine yayılan karbondioksit
meydana çıkar. Zehirlenme yaşanmaması için ortamın iyi havalandırıldığından emin
olunmalıdır. Kuru buz teması halinde ciddi yanıklara sebep olabilir, bu nedenle
koruyucu gözlük ve uygun eldiven kullanılmalıdır.
Önemli Not: Aşıyı uygulayan kişinin potansiyel olarak enfeksiyöz vücut sıvılarıyla
muhtemel temas riski ya da ellerinde açık yara bulunmadığı sürece aşı uygulayan
kişilerin eldiven kullanması önerilmez. Giyildiğinde ise el hijyenine dikkat edilerek
her aşılama sırasında eldiven değiştirilmelidir.
HAZIRLANMASI
- Aşı flakonları kuru buz içerisinde 15 gün süresince muhafaza edilebilmektedir. 15
günün sonunda flakonlar sulandırılmamak kaydıyla 5 gün (120 saat) süresince +2
ile +8°C arasında saklanabilir. - Kuru buzdan, -80°C’den veya -20°C’den çıkartılan donmuş flakonlar +2 ile +8°C
arasında 2-3 saat içerisinde, oda sıcaklığında ise hızlıca 30 dakikada erir. - Kuru buzdan, -80°C’den veya -20°C’den çıkartılan donmuş flakonlar, erimesi için
sulandırılması öncesinde 25°C‘ye kadar oda sıcaklığında en fazla 2 saat muhafaza
edilebilir. Flakonlar bu sürenin sonunda ya sulandırılmalı ya da aşı dolabına/
buzdolabına geri konulmalıdır. - Aşı kullanılmadan önce sulandırılarak seyreltilmelidir.
- Çoklu dozlu flakonun sulandırılmadan önce erimiş olması beklenmelidir.
- Erimiş flakon oda sıcaklığında iken sulandırılmalı ve sulandırılmadan önce
nazikçe ve yavaşça 10 kez ters yüz edilmelidir. Çalkalanmamalıdır. - Sulandırılmamış flakonun görünümü beyaz-kirli beyaz arası renkte donmuş çözelti şeklinde olup beyaz-kirli beyaz renkte opak amorf partiküller içerebilir. Sıvıda
herhangi bir renk değişikliği veya başka partiküller görüldüğünde ya da sıvı renksiz
hale gelirse flakon kullanılmadan uygun şekilde imha edilmelidir. - Erimiş aşı kendi flakonunda tek kullanımlık enjeksiyonluk, steril apirojen binde
9’luk (%0,9) NaCl (serum fizyolojik) çözeltisinden enjektör ile 1,8 ml çekilerek asepsi
kurallarına uygun olarak sulandırılır. Bundan başka bir sulandırıcı kullanılamaz. - Sulandırmak için kullanılacak ayrı bir steril enjektöre 1,8 ml binde 9 (%0,9) steril
serum fizyolojik çözeltisi çekilir. - Aşı flakonunun tıpası antiseptikle silinir.
- Enjektöre çekilen 1,8 ml binde 9 (%0,9) steril serum fizyolojik çözeltisi flakona eklenir.
- Flakonun 1,8 ml binde 9 (%0,9) steril serum fizyolojik çözeltisi ile sulandırılmasını takiben boş sulandırma enjektörü flakon içerisinden çıkartılmadan önce flakon dik durumdayken enjektör ile 1,8 ml hava çekilerek flakon basıncı eşitlenmelidir.
- Flakon sulandırıldıktan sonra nazikçe ve yavaşça 10 kez ters yüz edilmelidir. Çalkalanmamalıdır.
- Sulandırılmış flakonun görünümü kirli beyaz bir çözelti şeklindedir. Flakonda herhangi bir partikül görülmemelidir, herhangi bir partikül veya renk değişikliği görüldüğünde ya da sıvı renksiz hale geldiğinde, sulandırılmış flakon kullanılmadan uygun şekilde imha edilmelidir.
- Flakon sulandırılmadan önce veya sulandırıldıktan sonra görünümünde beklenmeyen bir durum gözlemlendiğinde, bu durum mümkünse fotoğraf ile belgelenmeli ve tutanak tutularak Halk Sağlığı Genel Müdürlüğü Aşı ile Önlenebilir Hastalıklar Daire Başkanlığına iletilmek üzere aşının tedarik edildiği birime en hızlı şekilde bilgi verilmelidir.
- Flakon sulandırıldıktan sonra en geç 6 saat içerisinde kullanılacak şekilde planlanma yapılmalıdır.
- 6 saatin sonunda flakonda aşı kaldı ise kullanılmamalı ve uygun şekilde imha edilmelidir.
- Sulandırılma saati, sulandırılan flakonun üzerine kaydedilerek +2 ile +8°C arasında muhafaza edilmelidir.
- Sulandırılan flakon başka bir yere taşınmamalı, aşının uygulandığı sağlık kurumunda bulunan aşı dolabında/buzdolabında muhafaza edilmelidir.
- Flakon sulandırıldıktan sonra asepsi kurallarına uygun olarak flakonun tıpası antiseptikle silinmeli ve Sağlık Bakanlığı tarafından bu aşıya özel olarak dağıtılan 1 ml’lik enjektöre, sulandırılmış flakon içerisinden 1 doz (0,3 ml) aşı çekilerek bekletmeden uygulanmalıdır. Başka bir enjektör kullanılmamalıdır.
- Her bir doz 0,3 ml içermelidir.
- Sulandırılarak kullanıma hazırlanmış olan flakonun içerisinde 6 uygulamalık aşı dozu bulunmaktadır. Her bir doz 0,3 ml olacak şekilde aşı çözeltisi çekilerek uygulanır. 6 doz aşı çekilmesi sonrasında flakonda kalan miktar yeni bir aşı dozu olarak kullanılmadan uygun şekilde imha edilmelidir.
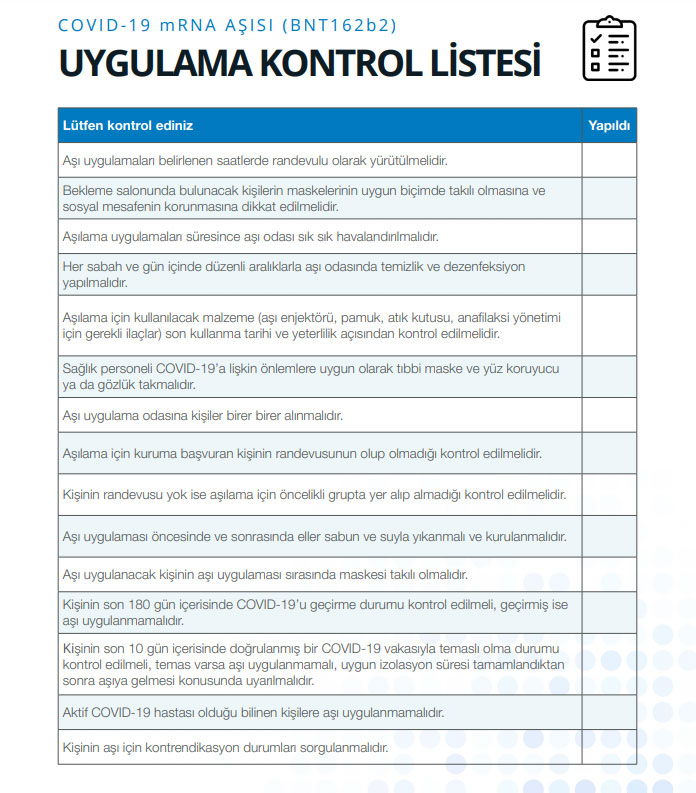
UYGULAMA KONTROL LİSTESİ